Diabete
Il dolore rappresenta un problema di grande rilevanza che affligge i pazienti affetti da lesioni cutanee, in grado di influenzare negativamente la qualità della vita, in particolare quelli affetti da piede diabetico, fenomeno attribuibile alle caratteristiche della patologia ed ai meccanismi sottostanti. È necessario comprendere che il dolore è legato al tipo di ferita e presenta livelli di intensità variabile, come diversa è la modalità con cui lo stesso sarà percepito. Pertanto è importante per gli operatori sanitari conoscere i meccanismi fisiopatologici alla base delle complicanze del diabete, come le neuropatie diabetiche, per essere in grado di gestire i fattori in grado di incidere negativamente e valutare le opzioni di trattamento disponibili all'interno delle strutture sanitarie di appartenenza.
Forme di neuropatia diabetica, conoscerle e riconoscerle
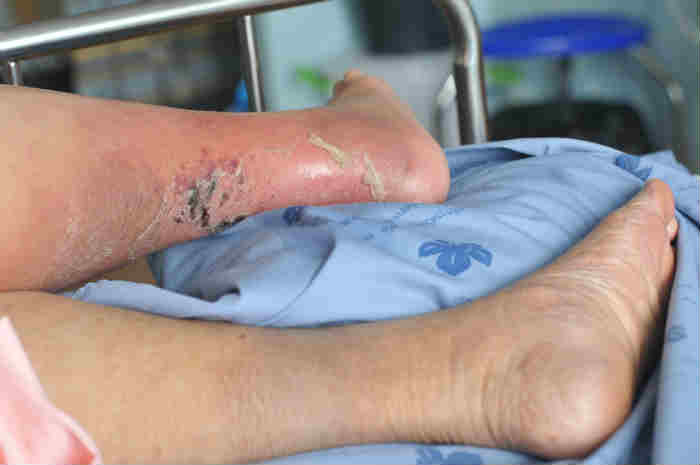
Le neuropatie sono tra le complicanze più rischiose del diabete
Il diabete costituisce una delle patologie in continua crescita nel mondo Occidentale, tanto da assumere i contorni di una pandemia del III° millennio (costituisce la quarta o quinta causa di mortalità nei paesi industrializzati).
Si stima che circa 387 milioni di persone - pari al 6-7% della popolazione mondiale - sia affetta da tale patologia, il 68% dei quali con un’età superiore a 68 anni. Circa l’80% delle persone affette da diabete vivono nei paesi industrializzati (IWGDF 2015), mentre tra il 5-7% ne è affetto in maniera inconsapevole.
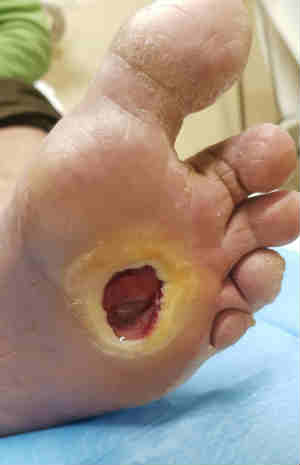
La neuropatia diabetica rappresenta una delle complicanze più frequenti del diabete, che coinvolge differenti porzioni del sistema nervoso e con diversificate manifestazioni cliniche.
Il riconoscimento precoce ed un’appropriata gestione della neuropatia dei pazienti affetti da diabete è importante per una serie di motivi (Rodica PB. et al, 2017):
- la diagnosi di neuropatia viene eseguita dopo la diagnosi differenziale con altre patologie
- possibilità di terapie appropriate per il trattamento dei sintomi
- più del 50% dei pazienti con neuropatia diabetica può essere asintomatico e la diagnosi avvenire in maniera tardiva
- il riconoscimento e il trattamento della neuropatia sensitiva, motoria e autonomica possono ridurre una serie di sintomi e migliorare la qualità di vita
Tra le varie forme di neuropatia diabetica la Polineuropatia Simmetica Distale (PNSD), la Neuropatia Autonomica Diabetica e la Neuropatia Autonomica Cardiovascolare (CAN) rappresentano di gran lunga le più studiate per la loro rilevanza.
L’obiettivo di fondo è quello di prevenire il danno dei nervi o rilevare precocemente i segni e i sintomi di una neuropatia, fondamentale nella pratica clinica per intervenire allo stadio iniziale, limitando i danni causati dalla disfunzione del sistema nervoso.
Neuropatia sensomotoria simmetrica distale - DSPN
Per neuropatia sensomotoria simmetrica distale (DSPN) s’intende una complicanza a lungo termine della malattia diabetica caratterizzata sul piano clinico dalla presenza di segni e sintomi di disfunzione dei nervi periferici, riconducibile ad alterazioni metaboliche e del microcircolo, in seguito ad una esposizione cronica di iperglicemia ed a fattori di rischio cardiovascolare, diagnosi accertabile solo dopo aver escluso la genesi di altre cause (Solomon T, et al. 2010).
Studi di coorte suggeriscono che la DSPN si verifica nel 20% dei diabetici di tipo I dopo 20 anni di malattia e in circa il 10- 15 % dei diabetici di tipo II con nuova diagnosi, aumentando fino al 50% dopo 10 anni di malattia, (Solomon et al, 2010, Rodica PB et al, 2017).
La patogenesi è riconducibile ad uno stress ossidativo e infiammatorio (aumentato flusso di poliolo e prodotti finali della glicazione) in un contesto di disfunzione metabolica delle cellule nervose, associato alla iperglicemia e alla presenza di fattori di rischio cardiovascolari (Rodica PB et al, 2017).
La DSPN è la più importante causa di ulcerazione del piede nel soggetto diabetico ed è anche un pre-requisito nello sviluppo della neuroartropatia di Charcot.
Rappresenta anche la principale causa di cadute e fratture, per la disfunzione delle piccole e grandi fibre nervose, per la perdita della percezione sensoriale, propriocezione, della capacità di controllo della temperatura (caldo/freddo) e del dolore.
Per stimare la gravità della DSPN, (Dick PJ, 1988) è stata proposta una scala di valutazione, suddivisa in tre gradi.
| Grado 0 | Normali deviazioni di Nerve Conduction < 95th percentile |
| Grado 1 A | Anormalità di NC > 95th percentile ma senza segni e sintomi (quali diminuzione della sensibilità distale o assenza del riflesso della caviglia) |
| Grado 1 B | Anormalità di NC con più segni di neuropatia, in assenza di sintomi |
| Grado 2 A | Anormalità di stadio 1° con o senza segni, ma con tipici sintomi di neuropatia |
| Grado 2 B | Anormalità di stadio 1 A, un moderato grado di debolezza di dorso-flessione della caviglia, con o senza sintomi di neuropatia |
La definizione dei criteri minimi per stabilire la presenza di DSPN (Solomon et al, 2010) è la seguente:
- Possibile DSPN: riferita sensazione di intorpidimento, formicolio o dolore lancinante, bruciore o diminuzione della sensibilità, prevalentemente agli arti inferiori o alle dita dei piedi, o inequivocabile diminuzione o assenza del riflesso achilleo.
- Probabile DSPN: la combinazione di segni e sintomi di neuropatia con diminuita sensibilità distale e assenza del riflesso achilleo.
- Confermata DSPN: la presenza di anormalità della conduzione nervosa e di segni o sintomi di neuropatia.
- DSPN Subclinica: La presenza di neuropatia è confermata da una anormale conduzione nervosa anche in assenza di segni e sintomi.
La prima e la seconda definizione possono essere usate per la clinica, mentre la terza e la quarta per la ricerca.
Diagnosi di neuropatia
La diagnosi di neuropatia è prevalentemente clinica, attraverso la descrizione dei sintomi riferiti dai pazienti, spesso con esacerbazioni notturne che vanno dal formicolio al dolore profondo, tagliente, una scossa elettrica o bruciore, oppure si presentano sotto forma di parestesie.
Il dolore neuropatico può essere accompagnato da una risposta esagerata agli stimoli dolorosi (iperalgesia) oppure essere evocato da contatto, come ad esempio con calze, scarpe e biancheria da letto (allodinia).
Più specificatamente il coinvolgimento delle grandi fibre induce la perdita della sensibilità protettiva (LOPS), formicolio senza dolore, addormentamento, scarso equilibrio.
Il coinvolgimento delle piccole fibre si evidenzia con dolore lancinante, bruciore, colpi come di scarica elettrica (Rodica PB et al, 2017).
La gravità del dolore può essere valutata utilizzando la scala analogica visiva del dolore o attraverso la scala numerica (Solomon et al, 2010).
Neuropatia sensitiva
La neuropatia sensitiva si caratterizza per una ridotta/abolita sensibilità agli stimoli tattili, termici, dolorifici e vibratori, che si traduce sul piano clinico in una perdita di dolore, di consapevolezza di pressione, di temperatura e di propriocezione e quindi nell’incapacità di riconoscere stimoli dannosi o traumi, causa di eventuali ulcerazioni.
Neuropatia motoria
La neuropatia motoria genera alterazioni della conformazione scheletrica con deformazione dei normali rapporti ossei e “debolezza” dell’articolazione tibio-tarsica, determinanti modifiche dell’appoggio plantare e di conseguenza una camminata anomala.
A livello clinico si rileva una deformità del piede con dita in griffe o dell’arcata plantare (piede piatto o piede cavo) con sviluppo di aree di iperpressione e di ipercheratosi plantare: la deformità del piede, le anomalie del passo e la limitata mobilità articolare, determinano un’alterazione del carico biomeccanico, con elevate pressioni plantari e probabilmente un aumento delle forze di spinta.
A livello pratico si traduce in un’alterata fase di carico, minore variabilità e lunghezza del passo e ridotta velocità di marcia. L’ipercheratosi rappresenta un tentativo di difesa dell’organismo in risposta ad una zona di ipercarico, caratterizzata da incremento dello strato corneo.
La presenza di una ipercheratosi agisce come un corpo estraneo sulla superficie della pelle, contribuendo ad aumentare la pressione locale (Documento di Consenso Internazionale Piede Diabetico, 2007).
La neuropatia motoria può essere individuata attraverso il test del riflesso Achilleo con manovra di rinforzo e con manovre per rilevare la mobilità articolare (joint mobility).
Neuropatia autonomica diabetica
La Diabetic Autonomic Neuropathy o DAN è un disordine del sistema nervoso autonomico in un contesto di malattia diabetica o di squilibrio metabolico di pre-diabete.
La DAN può avere effetti sul sistema cardiocircolatorio, sull’apparato gastrointestinale, urogenitale e sulla sudorazione.
Neuropatia autonomica cardiovascolare
La Cardiovascular Autonomic Neuropathy o CAN è definita come la compromissione del controllo del sistema cardiovascolare autonomo. La prevalenza di CAN varia dal 2,5% al 50%.
I fattori che incidono sui dati della prevalenza dipendono dai criteri diagnostici utilizzati, dall’età del paziente e dalla durata del diabete.
Altri fattori predittivi possono includere (Solomon T. et al, 2010, Rodità PB. et al, 2017):
- controllo glicemico
- presenza di Polineuropatia simmetrica distale (DSPN)
- presenza di nefropatia e/o retinopatia
- obesità
- ipertensione arteriosa
- fumo di sigaretta
- alti livelli di colesterolo e trigliceridi
I sintomi più comuni possono manifestarsi in posizione eretta e includono vertigini debolezza, palpitazioni e sincope. Nelle sue prime fasi può essere asintomatica e rilevabile con la diminuzione della frequenza cardiaca con la respirazione profonda.
Nei casi più avanzati si manifesta sul piano clinico con tachicardia a riposo >100 bpm e scarsa tolleranza all’esercizio fisico, ipotensione ortostatica con diminuzione fino a 20 mmHg (per la sistolica) o 10 mmHg (per la diastolica) senza un adeguato aumento della frequenza, a causa del rilascio di norepinefrina da parte di neuroni del sistema simpatico (Spallone V. et al., 2011, American Diabetes Association, 2017).
Un ulteriore sintomo rilevabile è l’attenuazione o perdita della caduta notturna della pressione arteriosa (reverse dipping) attribuibile alla rottura del ritmo circadiano nell’attività simpatico-vagale (Solomon T. et al, 2010).
Lo screening per CAN deve essere eseguito alla diagnosi per diabete di tipo II e 5 anni dopo il diabete di tipo I, in particolare per i pazienti considerati a maggior rischio a causa di uno scarso controllo glicemico, in presenza di fattori di rischio cardiovascolare, DSN e complicanze vascolari come la micro e macro-angiopatia (Solomon T. et al, 2010).
A tale scopo risulta utile eseguire la rilevazione della pressione sanguigna in posizione ortostatica e supina e la manovra di Valsalva. Quest’ultima non deve essere eseguita in caso di retinopatia.
Neuropatia autonomica gastrointestinale
La neuropatia autonomica a livello gastrointestinale si caratterizza per la presenza di disturbi che possono interessare qualsiasi tratto dell’apparato digerente, incluso l’esofago (Camilleri M, et al. 2013), prevalentemente nei pazienti con diabete di tipo I (5%), rispetto a quelli con diabete di tipo II (1%).
Le funzioni secretorie, sensoriali e motorie del sistema nervoso autonomo a livello gastrico sono modulate dalle cellule interstiziali di Cajal, situate all’interno della muscolatura liscia, fondamentali per il mescolamento e la progressione del cibo nell’intestino (Solomon et al. 2010).
La neuropatia è causa di dismotilità e gastroparesi con ritardato svuotamento gastrico, che si manifesta sul piano clinico con sazietà precoce, pienezza, gonfiore, nausea e vomito, dispepsia, dolore addominale, costipazione, diarrea e incontinenza fecale.
Il rallentamento dello svuotamento gastrico può essere determinato anche da un’iperglicemia, mentre viene accelerato in caso di ipoglicemia indotta dall’insulina.
A livello dell’apparato genito-urinario la neuropatia autonomica può causare la disfunzione della vescica (urgenza ad urinare) e della sfera sessuale (disfunzione erettile), tre volte più frequente negli uomini, affetti da diabete rispetto alla popolazione maschile sana (Giugliano et al. 2010).
La disfunzione erettile è causata oltre che dalla neuropatia anche dalla glicazione delle fibre elastiche, dalla vasculopatia periferica, dalla disfunzione endolteliale, da fattori psicologici, droga, oltre che da variazioni ormonali (Solomon et al, 2010) con una percentuale che va dal 35% fino al 90%.
La disfunzione della vescica è causata da un’alterazione neuronale del muscolo liscio detrusore, nel 43-87% dei diabetici di tipo I e nel 25% dei diabetici di tipo II.
I sintomi più comuni sono: disuria, nicturia, aumento della frequenza e dell’urgenza, incompleto svuotamento della vescica, pollachiuria, esitazione nell’iniziare la minzione, cistiti ricorrenti, incontinenza urinaria.
La disfunzione del sudore da parte delle ghiandole sudoripare, innervate dalle fibre postgangliari colinergiche amieliniche, si manifesta con pelle secca, anidrosi o intolleranza al caldo.
La xerosi o secchezza cutanea può portare alla formazione di fissurazioni che possono costituire un veicolo d’entrata per i germi (soprattutto a livello del tallone) e portare a gravi infezioni.
Una rara forma di disfunzione del sudore è quella legata al consumo di cibo e/o dall’odore, che innesca una ipersudorazione nella sola regione della testa o del collo (Casellini CM, et al.2013).
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?