La leucemia linfatica cronica (LLC) è una neoplasia ematologica che consiste in un accumulo di linfociti nel sangue, nel midollo osseo e negli organi linfatici (linfonodi e milza). Questa tipologia di leucemia si definisce cronica in quanto ha quasi sempre un decorso molto lento, spesso senza sintomi o con pochi disturbi per il paziente, che può continuare a svolgere una vita normale per molti anni senza che siano necessari provvedimenti terapeutici.
Epidemiologia di LLC
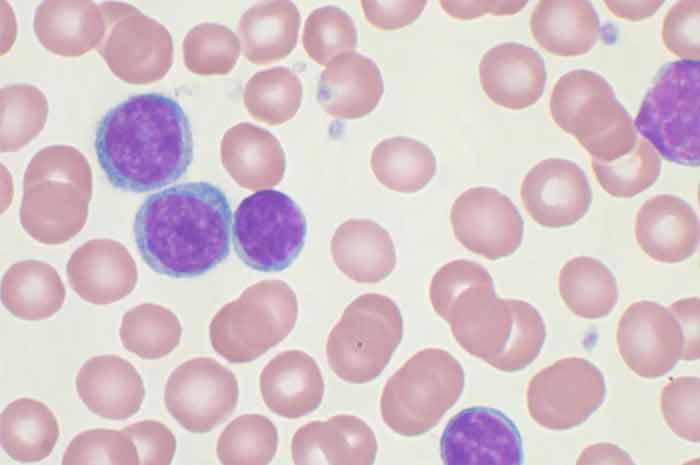
Leucemia linfatica
La leucemia linfatica cronica rappresenta la tipologia di leucemia più comune nel mondo occidentale ed è tipica nell’anziano. L’età media alla diagnosi si aggira attorno ai 70 anni e meno del 15% dei casi viene diagnosticato prima dei 60 anni.
Ogni anno questa patologia colpisce circa 5 persone su 100.000 e l’incidenza aumenta con l’aumentare dell’età.
In Italia le stime parlano di circa 1.600 nuovi casi ogni anno tra gli uomini e 1.150 tra le donne.
Non esiste una prevenzione specifica (stili di vita, abitudini alimentari, esposizione a radiazioni, ecc.) per questa malattia.
Fisiopatologia della leucemia linfatica cronica
Nel 98% circa dei casi di LLC, le cellule B CD5+ vanno incontro a una trasformazione maligna, con linfociti che inizialmente si accumulano nel midollo osseo e quindi diffondono nei linfonodi e in altri tessuti linfatici, inducendo infine splenomegalia ed epatomegalia.
Con il progredire della malattia, l’emopoiesi anomala conduce ad anemia, neutropenia, trombocitopenia e ridotta produzione di immunoglobuline. Molti pazienti sviluppano ipogammaglobulinemia e alterata risposta Ac, la quale probabilmente è correlata a un aumento dell’attività dei linfociti T-soppressori.
I pazienti presentano un aumento della predisposizione a patologie autoimmuni caratterizzate da anemie immunoemolitiche (in genere positive al test di Coombs) o trombocitopenia e un modesto aumento del rischio di sviluppare altre neoplasie maligne.
Nel restante 2-3% dei casi, l’espansione clonale è di tipo T e anche questo gruppo presenta un sottotipo (ad esempio grandi linfociti granulari con citopenia).
Inoltre, nell’ambito della leucemia linfocitica cronica sono state identificate altre tipologie leucemiche croniche:
- Leucemia prolinfocitica
- Fase leucemica del linfoma cutaneo a cellule T (sindrome di Sézary)
- Leucemia a cellule capellute
- Linfoma che progredisce a leucemia (cambiamenti leucemici che si verificano nelle fasi avanzate di linfoma maligno)
La differenziazione di questi sottotipi dalla tipica leucemia linfocitica cronica è di solito fatta attraverso l’esame morfologico in microscopia ottica e l’immunofenotipo.
LLC e fattori di rischio
Attualmente gli agenti o i comportamenti in grado di provocare l’insorgenza della malattia sono poco conosciuti. La LLC non sembra condividere con altri tumori del sangue un aumento del rischio correlato all’esposizione alle radiazioni ionizzanti per terapia, motivi professionali o accidentali.
La malattia potrebbe tuttavia essere provocata dall’esposizione a fattori ambientali in grado di modificare il genoma di un individuo, ma gli stessi non sono stati ancora riconosciuti.
Pur non trattandosi di una malattia genetica, si osserva una certa familiarità: i parenti di primo grado dei pazienti affetti da leucemia linfatica cronica fanno registrare un’incidenza più alta della malattia rispetto alla normale popolazione.
Sintomi di leucemia linfatica cronica
In più della metà dei pazienti, la LLC viene diagnosticata casualmente nel corso di un esame del sangue eseguito per un’altra ragione, oppure perché si nota un linfonodo ingrossato nel collo, nelle ascelle o all’inguine. Infatti, in circa due casi su tre la diagnosi avviene in uno stadio ancora asintomatico.
Il sintomo più frequente di LLC è l’adenopatia generalizzata: i linfonodi appaiono di consistenza elastica e non sono dolorosi al tatto; sono frequenti anche la splenomegalia e l’epatomegalia.
Con il progredire della malattia possono comparire altri sintomi comuni anche alle altre leucemie, i quali sono provocati dall’invasione del midollo osseo da parte delle cellule maligne che soppiantano le cellule ematiche normali.
Tali sintomi comprendono astenia, pallore e palpitazioni per via dell’anemia ed emorragie causate dalla riduzione delle piastrine. Inoltre, l’aumento dei linfociti impedisce la produzione nel midollo osseo delle altre cellule di difesa: per questo i pazienti sono spesso immunodeficienti e per questo predisposti a infezioni e sintomi come febbre non spiegata, sudorazione notturna e dolori articolari.
Circa 5 pazienti su 100 presentano anche disturbi autoimmuni quali anemia emolitica e piastrinopenia.
Diagnosi di leucemia linfatica cronica
La diagnosi di LLC deve essere eseguita presso un centro specializzato di Ematologia clinica attraverso alcuni accertamenti tra cui i principali sono:
- Esame emocromocitometrico: misura il numero di globuli bianchi, rossi e piastrine del sangue periferico e dettaglia in percentuale e valore assoluto i 5 principali tipi di globuli bianchi (i granulociti neutrofili, eosinofili e basofili, i monociti ed i linfociti), le cui caratteristiche morfologiche possono anche essere esaminate più approfonditamente al microscopio
- Aspirato e biopsia del midollo osseo: entrambe le procedure vengono eseguite introducendo un ago nella spina iliaca postero-superiore. Con l’aspirato midollare, una volta posizionato opportunamente l’ago in anestesia locale, si procede a 2-4 brevi ripetute aspirazioni della durata di pochi secondi, allo scopo di raccogliere adeguati campioni di midollo osseo. La biopsia osteomidollare, invece, è una procedura eseguita sempre in anestesia locale che prevede l’estrazione di un piccolo cilindro d’osso con un apposito ago. Queste due procedure per l’inquadramento clinico-prognostico nel sospetto di LLC possono essere discrezionali, anche se sono fortemente indicate prima dell’inizio di qualsiasi trattamento
- Analisi morfologica: consiste nell’esaminare al microscopio ottico le caratteristiche morfologiche delle cellule midollari presenti in campioni di aspirato midollare e sangue periferico. Fornisce importanti informazioni per la diagnosi e la definizione della fase di malattia
- Analisi citogenetica/FISH: consente di esaminare il numero e la struttura dei cromosomi delle cellule midollari presenti in campioni di aspirato midollare o sangue periferico. Alcune peculiari alterazioni cromosomiche possono essere associate ad una prognosi sfavorevole
- Analisi immunofenotipica: permette di esaminare le caratteristiche di superficie delle cellule di LLC presenti in campioni di aspirato midollare e/o sangue periferico, facilitando la diagnosi e, in alcuni casi, permettendo di monitorare nel tempo la risposta ai trattamenti
- Analisi molecolare: è utile per esaminare la presenza nelle cellule midollari di campioni di aspirato midollare e/o sangue periferico di “marcatori molecolari” di malattia che possono facilitare l’inquadramento prognostico e permettere di monitorare nel tempo la risposta ai trattamenti. I “marcatori molecolari” originano da alterazioni cromosomiche o del DNA
- Biopsia linfonodale: l’analisi in laboratorio di un campione di un linfonodo patologico permette di stabilire l’eventuale localizzazione di LLC linfatico nel tessuto linfatico
Stadiazione di LCC
Nel corso degli ultimi decenni si sono sviluppate diverse classificazioni. La prima, ideata da Kanti R. Rai nel 1975, prevede 5 differenti fasi di stadiazione:
- Stadio 0: Linfocitosi assoluta > 10 000/μL nel sangue e con ≥ 30% di linfociti nel midollo osseo
- Stadio I: stadio 0 più linfoadenomegalia
- Stadio II: stadio 0 più epatomegalia o splenomegalia
- Stadio III: stadio 0 più anemia con Hb < 11 g/dL
- Stadio IV: stadio 0 più trombocitopenia con conta piastrinica < 100 000/μL
Successivamente, nel 1981 Jacques-Louis Binet ha raggruppato in maniera differente la classificazione secondo Rai, definendo 3 stadiazioni:
- Stadio A: Linfocitosi assoluta > 10 000/μL nel sangue e con ≥ 30% di linfociti nel midollo osseo, Hb ≥ 10 g/dL, Piastrine ≥ 100 000/μL, ≤ 2 sedi coinvolte (cervicale, ascellare e linfonodi inguinali; fegato; milza)
- Stadio B: come stadio A, ma 3-5 siti coinvolti
- Stadio C: come stadio A o B, ma Hb < 10 g/dL o piastrine < 100 000/μL
Prognosi per i pazienti con leucemia linfatica cronica
La sopravvivenza media dei pazienti con LLC a cellule B o con le sue complicanze è di circa 7-10 anni.
I pazienti in stadio Rai 0-II al momento della diagnosi possono sopravvivere per 5-20 anni senza trattamento, mentre i pazienti in stadio Rai III o IV hanno una maggior probabilità di decesso entro 3-4 anni dalla diagnosi.
La progressione fino all’insufficienza midollare è in genere associata a un accorciamento della sopravvivenza.
Inoltre, si correlano con una cattiva prognosi:
- Esordio di malattia in stadio avanzato
- Doubling time della conta dei linfociti < 12 mesi
- Presenza di sintomi sistemici e infiltrazione di tipo diffuso
- Assenza di mutazioni a carico del gene igvh
- Espressione di superficie del marcatore cd38
- Espressione della tirosin-chinasi zap-70
- Presenza di delezioni 11q e 17p
Come si tratta la leucemia linfatica cronica
Il trattamento della leucemia linfatica cronica è personalizzato in base ai sintomi del paziente, allo stadio della malattia e alla prognosi. In molti casi senza alcun segno di progressione della malattia è sufficiente una periodica osservazione per diversi anni senza la necessità di alcun trattamento.
Nel momento in cui si rende necessario quest’ultimo, le opzioni comprendono la chemioterapia, la terapia con anticorpi monoclonali o una combinazione di entrambe. Per alcuni soggetti selezionati, si fa sempre più strada anche il ruolo del trapianto di midollo osseo (cellule staminali emopoietiche) da donatore (allogenico).
Osservazione
A seconda dello stadio della leucemia linfatica cronica, la sorveglianza attenta delle condizioni del paziente e la periodica esecuzione di esami biochimici e strumentali di controllo rappresentano spesso un approccio terapeutico appropriato.
I criteri per decidere se iniziare la terapia oppure no sono i seguenti:
- Il tempo di raddoppiamento del numero dei linfociti (indice della rapidità di diffusione della malattia) in tempo minore a 6 mesi (valido come unico criterio solo in caso di linfocitosi basale > 30000)
- Presenza di anemia (emoglobina < 10) o piastrinopenia (< 100000)
- Presenza di linfadenopatie > 10 cm o linfonodi che crescono rapidamente
- Presenza di splenomegalia sintomatica o progressiva
- Presenza di sintomi b quali febbre > 38°c, sudorazioni profuse notturne, calo di peso > 10kg in 6 mesi
- Presenza di infezioni recidivanti
- Presenza di anemia emolitica non responsiva al cortisone
Il valore assoluto dei linfociti non rappresenta da solo un criterio sufficiente per iniziare la terapia, anche quando i linfociti raggiungono valori molto alti: ciò che conta è la rapidità con cui i linfociti aumentano.
Chemioterapia
Attualmente sono disponibili numerosi farmaci chemioterapici che possono essere somministrati per via endovenosa o per via orale.
L’obiettivo della terapia è quello di eliminare il maggior numero di cellule leucemiche, prestando molto attenzione ai possibili effetti indesiderati ed alle complicanze infettive che ne possono conseguire.
Terapia con anticorpi monoclonali
Gli anticorpi monoclonali sono proteine prodotte artificialmente che, una volta somministrati per via endovenosa o sottocutanea, sono in grado di colpire selettivamente le cellule leucemiche legandosi ad esse e attivando meccanismi che ne determinano rapidamente la morte, risparmiando i tessuti sani.
Il rituximab è l’anticorpo monoclonale ad oggi più utilizzato.
Chemio-immunoterapia
Uno dei progressi terapeutici più significativi degli ultimi anni è stato lo sviluppo di un trattamento di combinazione di chemioterapia con anticorpi monoclonali (chemio-immunoterapia), che si traduce in un effetto sinergico ed in un più elevato tasso di risposta clinica.
Alcuni esempi di questi farmaci sono gli anticorpi antiCD20 quali ofatumomab e obinotuzumab, che possono essere utilizzati in combinazione alla chemioterapia.
Se vi è la presenza di delezione 17p o mutazione p53, ovvero in caso di LLC solitamente resistente alla chemioterapia, oggi esistono nuovi farmaci molecolari molto efficaci: l’ibrutinib e il venetoclax (quest’ultimo da utilizzare in caso di controindicazioni o non risposta a ibrutinib).
Per le linee di terapie successive è possibile utilizzare anche idelalisib. Infatti, questi farmaci possono essere anche utilizzati nei casi di LLC in recidiva in assenza di delezione 17p o mutazione p53, in particolare in caso di recidiva precoce dopo chemio-immunoterapia.
I nuovi farmaci, agendo su un bersaglio preciso ed essendo quindi più efficaci e meno tossici, hanno completamente cambiato la prognosi e la fattibilità delle terapie nei pazienti con LLC e si attende un loro più ampio e precoce utilizzo nel decorso della malattia.
Il loro potenziale svantaggio risiede nel dover essere presi continuativamente, come una terapia cronica e la mancanza di dati numerosi nel lungo termine.
Trapianto di cellule staminali emopoietiche
Nelle persone con una forma più aggressiva o recidivante di leucemia linfatica cronica si è dimostrato promettente il ricorso al trapianto di cellule staminali emopoietiche da donatore sia familiare sia da registro.
Il trapianto allogenico nella LLC prevede una terapia di preparazione (regime di condizionamento) ad intensità ridotta, dunque praticabile anche in soggetti fino a 70-75 di età.
L’indicazione al trapianto deve essere preceduta da un’attenta valutazione delle condizioni cliniche del soggetto e da un’approfondita e condivisa analisi dei rischi e benefici.
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?