
0445f454d93c4fcc0efc1c70de029529

GUBBIO. Comitati etici, burocrazie e tagli ai fondi. Nel nostro paese la ricerca farmacologica ha subito un notevole calo finendo per essere fanalino di coda in molti studi. E se andiamo a vedere i dati nel mondo scopriamo che sono i paesi con le economie in forte espansione a prendere il sopravvento. Con controlli meno rigidi. Un bene o un male?
COME LE INDUSTRIE FARMACEUTICHE ARRIVANO A TROVARE IL POTENZIALE "CAVALLO DI BATTAGLIA"
Dietro ogni farmaco prodotto dalle Industrie farmaceutiche, immesso in commercio e consumato, c’è almeno un decennio di ricerca e investimenti dell’industria.
Dalla prima intuizione di base, si passa dopo circa cinque anni ai test preclinici. Se i primi risultati di questi sono positivi, si può accedere allo step successivo, ossia quello della ricerca clinica sul farmaco, dove i risultati raggiunti vengono per la prima volta testati sui pazienti. Generalmente sono volontari sani ed entraranno a far parte di un processo che dovrà valutare la sicurezza e l’efficacia della molecola in studio nella cura della patologia.
Questo percorso impiega circa un decennio e da circa 10.000 molecole “potenzialmente” prese in considerazione dagli scienziati i test ne selezionano all’incirca 100 su cui puntare e spendere risorse e investimenti per arrivare ad un nuovo brevetto.
Di queste 100, ricerche più dettagliate ne promuovono solo una decina e forse tra queste gli scienziati trovano una molecola fortunata che diventerà un farmaco da mettere sul commercio. Preferibilmente un “cavallo di battaglia” dell’Industria, ma siamo solo all’inizio.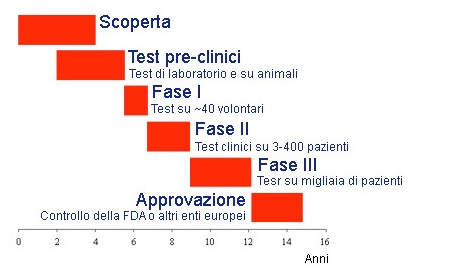
UNA RICERCA LUNGA COSTA DENARO ALLE MULTINAZIONALI
 Se il nuovo farmaco è realmente utile e sicuro lo stabilisce l’autorità, e per fare questo trascorrono altri due o tre anni.
Se il nuovo farmaco è realmente utile e sicuro lo stabilisce l’autorità, e per fare questo trascorrono altri due o tre anni.
Quando finalmente avviene il riconoscimento e l’immissione sul mercato, il farmaco inizierà a far guadagnare l’industria che ne ha progettato e pagato lo sviluppo e la ricerca.
Di conseguenza verrà protetto da un brevetto ventennale che frutterà all’industria miliardi di euro, ma continuerà ad essere sotto osservazione grazie alla farmacovigilanza che ne controlla e registra gli effetti indesiderati sui pazienti che hanno iniziato l’assunzione.
Il costo di sviluppo di un farmaco è progressivamente cresciuto negli anni, fino a raggiungere, per alcune classi valori vicini al miliardo di dollari.
Secondo uno studio condotto dal “Journal of Healt Economics” sui costi dello sviluppo di nuovi farmaci, il costo totale in ricerca (preclinica e clinica) per l’approvazione di un nuovo medicinale è pari a 802 milioni di dollari. Per alcuni esperti è un valore che addirittura sottostimato, perché non include i reali costi pre registrativi nella fase IV richiesti dalle autorità di controllo.
L'ARTE DEL SAPER "ARRUOLARE" E' IL PRIMO PASSO PER IL SUCCESSO
Esistono quattro indicatori che strutturano il grado di efficienza del sistema della sperimentazione clinica: quantità, qualità, tempi e costi. Per chi non opera in questo settore l’efficienza si valuta nella precisa accuratezza della pianificazione. Occorre avere un ottimo database dei pazienti da sottoporre alla sperimentazione del farmaco, procedere al loro reclutamento rispettando i tempi di attivazione, evitare ritardi e lungaggini.
I centri specializzati (CRO), che operano per le aziende farmaceutiche in questo tipo di attività devono arruolare un numero ampio e conforme al protocollo di ricerca di pazienti.
La durata media di questo periodo è andata diminuendo velocemente, passando da 26 settimane del 1999 alle 13 settimane del 2003. L’obiettivo che gli operatori si sono proposti è quello di raggiungere entro il 2012 le 6 settimane per la maggior parte degli studi clinici.
Per quanto riguarda la qualità questa dovrebbe essere un must e cadere in fallo durante questa delicata fase, con tutta la documentazione necessaria, costa mediamente 100 dollari a singola correzione.
Se il dato sbagliato ha un rapporto di causa-effetto negativo sulla ricerca dal punto di vista economico, il dato mancante non si può alterare e arriva a modificare le fondamenta del disegno sperimentale e l’interpretazione dei risultati. Questo lavoro di altissima professionalità su quantità e qualità della ricerca deve viaggiare di pari passo con una tempistica opportuna, veloce e che riesca a limitare al massimo il prolungamento delle scadenze.
Per quanto riguarda i costi il loro lievitare è la conseguenza diretta dei tre punti precedenti e ha un valore numerico pari a un terzo dei costi interni che un’industria farmaceutica sostiene per la conduzione di una ricerca.
VOLONTARI UMANI PER SOLDI O PER DISPERAZIONE
La ricerca ha una grandissima necessità di cavie umane. Dopo aver trovato la molecola “giusta” bisogna capire che conseguenze avrà sul corpo umano.
Così ci sono aziende e centri che reclutano cavie sane disposte a sottoporsi per 4-10 giorni a una serie di analisi e somministrazioni.
Questa è la Fase I di uno studio clinico che riguarda massimo una quarantina di persone e non costa più di un milione di euro alle industrie farmaceutiche. Risulta importantissima perché lo studio di Fase I svelerà se quel farmaco fa male.
Così giovani, perlopiù sui 30-40 anni, sani o malati senza nessun’altra possibilità di cura efficace per la loro patologia, si sottopongono a questi esperimenti.
I primi lo fanno per un rimborso che può arrivare a 200-300 euro al giorno a seconda dei casi, i secondi per sperare in un aiuto della scienza e sottoporsi a cure non ancora approvate, sognando il miracolo.
Nella Fase II invece si iniziano ad arruolare più candidati, ma ci vogliono soprattutto i malati perché è in questo momento che si inizia a valutare se la molecola in studio è efficace.
IN ITALIA SI INVESTE SEMPRE MENO
In questi studi l’Italia è fanalino di coda, in Svizzera le ricerche in Fase I sono 150 all’anno di media, in Inghilterra si fanno oltre 200 studi ogni anno e negli Stati Uniti dove Big Pharma affida a società private questa procedura si stima che quasi 4 milioni di persone abbiano preso parte a sperimentazioni cliniche.
L’India è la nuova frontiera della ricerca di Fase I, qui si arriva anche a mille studi con costi decisamente inferiori. I progetti italiani in Fase I nel 2008, secondo l’Agenzia italiana del farmaco, sono stati 46, meno di 10 su volontari sani, prevalentemente su malati oncologici terminali.
Se poi si cerca un dato totale tra le quattro fasi della sperimentazione che portano a un nuovo farmaco, si arriva a malapena a 850. Paesi come Inghilterra e Germania superano i 200 studi solo in Fase I.
La ricerca farmacologica è costellata da varie difficoltà. Se poi osserviamo alcuni dati degli ultimi cinque anni ci accorgiamo che è stato registrato il 50% in meno di nuovi farmaci rispetto al quinquennio precedente.
Nel 2007 solo 19 nuove molecole sono state approvate della FDA (Food and drug administration) americana, il numero più basso dal 1983. Nel 2009 sono stati approvati 24 farmaci, di questi solo 10 sono stati sviluppati da grandi gruppi farmaceutici e solo il 17% era rappresentato da farmaci di prima classe. L’innovazione è sempre più una merce rara.
In Italia nel 2009, sono entrati in commercio complessivamente 293 principi attivi, analoghi per la gran parte a farmaci già presenti sul mercato nazionale. Solo 36 di questi prodotti, il 12% appena, rappresentano vere novità, cioè nuove o molecole o nuove associazioni di farmaci che non si trovavano prima nel nostro paese e sono farmaci soprattutto contro il diabete e nuovi antitumorali.
Quanta di questa ricerca viene fatta nella Penisola? Quanto di questo capitale tecnologico e umano ha trovato posto negli ultimi anni nel bel paese?
LE NUOVE FRONTIERE DELLA RICERCA FARMACOLOGICA : LE "E7"
La vera ricerca si fa nelle case madri delle ditte farmaceutiche o in alcuni Paesi dove la legislazione è meno rigida come ad esempio nell’Europa dell’Est o in Asia. La nuova frontiera è rappresentata dai Pesi emergenti definiti dagli esperti “E7”: Brasile, Russia, Cina, India, Messico, Turchia e Corea del Sud.
Questi Paesi hanno fame di investimenti, salute e innovazione e cercano di rendere veloce e competitivo lo sviluppo clinico di Fase III, quello caratterizzato dalla necessità di avere un’ampia casistica di pazienti.
Di questo passo tra un paio d’anni l’Europa occidentale potrebbe veder ridurre la sua quota di studi del 20-40%. La ricerca clinica sull’uomo è rallentata dai comitati etici e altro, è impossibile avere gli stessi tempi e risultati.
Se la ricerca pensa di avere tra le mani qualcosa di interessante, cerca di venderlo a qualcuno più grande che può spendere di più. Questo perché quando si trova una molecola e si vede un suo possibile successo, si è speso parecchio e per poterla portare sul mercato sono necessari altri investimenti. Qui intervengono le aziende più grandi che sono pronte ad investire.
Questo è lo “stato dell’arte” degli Studi Clinici nel nostro Paese dove la ricerca farmacologica è uno dei tanti settori dove oramai non si investe più.

















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?