Ci sono una serie di complicanze nel neonato legate all’iperossia. Prima fra tutte la Retinopatia del prematuro (Rop), ma possono esserci anche danni da stress ossidativo, bronco displasia polmonare e conseguenze sul sistema nervoso centrale del neonato.
Complicanze da iperossia nel neonato
Neonato prematuro
Retinopatia del prematuro (Rop), danni da stress ossidativo, bronco displasia polmonare, conseguenze sul sistema nervoso centrale. Ecco le complicanze nel neonato legate all’iperossia.
Retinopatia del prematuro (Rop)
A Boston negli anni Trenta venne introdotta per la prima volta la somministrazione in continuo di ossigeno e la frazione inspiratoria di Ossigeno (FiO2) = 0.8 come trattamento terapeutico di routine nei neonati prematuri.
Sebbene sin da allora la somministrazione in continuo, venga utilizzata come trattamento di routine nei neonati prematuri, il primo caso di Retrolental fibroplasia (RLF – paragonabile al V stadio dell'attuale International Classification of Retinopathy of Prematurity ) (Hellstrom, Smith, & Dammann, 2013) venne diagnosticato solamente nel 1942.
Inizialmente, l'ossigeno venne riconosciuto solo come causa marginale, poiché si pensava che a causare la Rlf fosse l'utilizzo di nuove incubatrici. Sembrava che queste, per la loro conformazione, avessero il vantaggio di mantenere un'alta concentrazione di O2 al loro interno, migliorando la sopravvivenza del bambino pretermine, a scapito della conservazione della sua funzionalità visiva. Campbell, nel 1951, fu il primo a suggerire che l’ossigeno, invece, aveva un ruolo chiave nell'incremento dell'epidemia di Rop in corso in quegli anni. Egli affermò che il “normale ambiente (in termini di quantità di O2) era anormale per il bimbo prematuro”, sottolineando l'alto rischio che una somministrazione inadeguata di O2, poteva rappresentare per questa categoria di pazienti. Successivi studi clinici randomizzati, effettuati intorno agli anni Cinquanta, confermarono quanto suggerito da Campbell, definendo come fattori di rischio principali per il fenomeno, l'iperossia e la prematurità.
Successivamente, vi fu una leggera flessione negativa fra gli anni Sessanta e Settanta, grazie all'introduzione di dure restrizioni sulla quantità di O2 somministrato. Questa scelta, tuttavia, provocò un incremento importante in termini di mortalità neonatale, spingendo gli operatori sanitari a cercare dei range di SpO2, nelle due decadi successive, che potessero rappresentare il miglior equilibrio in termini: di sopravvivenza del bambino e di conseguenze provocate dall'iperossia. Tutto questo fu permesso grazie all'introduzione nella pratica clinica del pulsossimetro. Malgrado la continua ricerca in questo campo e l'utilizzo di pulsossimetri via via più sensibili e tecnologici, la Rop rappresenta ancora oggi un problema molto rilevante soprattutto nelle realtà ospedaliere dei paesi più poveri e/o in via di sviluppo, per i quali si contano circa 50mila nuovi casi all'anno di cecità dovuta a questa patologia. Il motivo è insito nel fatto che il fattore prematurità è in continuo aumento, e ora, più che mai, “severo” (aumento degli extremely premature infants con Gestational Age [GA] < 28 settimane).
La patogenesi della retinopatia del prematuro, si articola su due fasi, denominate fase 1 e fase 2.
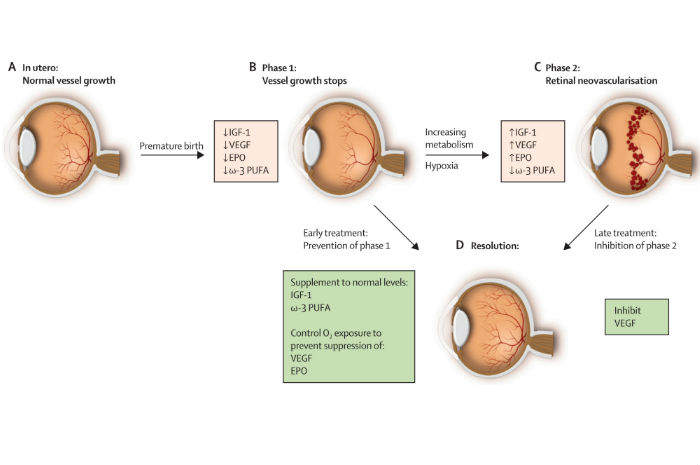
La patogenesi della retinopatia (clicca per ingradire)
La crescita dei vasi che irroreranno la retina inizia durante la 14esima e la 15esima settimana di gestazione, sviluppandosi dal nervo ottico e progredendo anteriormente e perifericamente. La prima fase della Rop, chiamata anche “vaso obliterante”, insorge generalmente nel periodo tra la nascita e la 30a/32a settimana post menstrual age (Pma) (Chen, Guo, Smith, Dammann, & Dammann, 2010), e vede direttamente coinvolta la componente iperossia. Va ricordato, che l'iperossia può insorgere anche in aria ambiente (FiO2 = 0.21), poiché la PaO2 risulta essere ben maggiore rispetto a quella intrauterina, mantenuta durante la seconda metà della gravidanza, ovvero PaO2 < 55mmHg (Hellstrom et al., 2013). Malgrado ciò, è l'O2 terapia a provocare un esponenziale e anormale incremento dei valori di SpO2 e di PaO2, dando il via alla fase 1 della Rop.
In questa fase, l'iperossia induce la soppressione dei fattori di crescita angiogenetica ossigeno mediati, in particolare l'eritropoietina e il vascular endothelial growth factor (Vegf), i quali a loro volta causano sia la cessazione della crescita da parte dei vasi retinici, sia la perdita dei vasi retinici esistenti. Questo, sommato alla caduta della quantità di insulin-like growth factor 1 (Igf – 1, fattore di crescita cruciale per il normale accrescimento e sviluppo di alcuni tessuti quali, ad esempio, quello cerebrale e i vasi sanguigni – esso è normalmente presente in ottime concentrazioni nell'utero durante il terzo trimestre di gravidanza) sembrano essere i maggiori promotori dell'arresto nella crescita dei vasi irroranti la retina.
La seconda fase della Rop inizia intorno alla 32esima – 34esima settimana Pma, ed è chiamata anche “fase proliferativa” (Chen et al., 2010). Allo sviluppo anteriore della retina senza il conseguente sviluppo dei vasi sanguigni in essa, si vengono a creare delle zone fisiologicamente ipossiche. L'ipossia media la produzione di Vegf per cui, durante la maturazione della retina avascolarizzata, quest'ultima diventa metabolicamente attiva e conseguentemente ipossica. Questa ipossia stimola ulteriormente la produzione di Vegf e di eritropoietina, i quali inducono una neo vascolarizzazione retinica. Simultaneamente, alla maturazione del neonato, vi è un sensibile aumento di Igf–1, il quale agisce regolando parzialmente l'attivazione del Vegf, permettendo la massima stimolazione di questo, verso la crescita di nuovi vasi sanguigni.
Questi vasi, tuttavia, risultano perfondere scarsamente la retina ed essere fragili, promuovendo così la formazione di una cicatrice fibrosa e il distacco retinico. Nella maggior parte dei neonati, la Rop regredisce spontaneamente e la retina viene vascolarizzata abbastanza normalmente, ma alcuni deficit neurali, come ad esempio la perdita della funzionalità dei fotorecettori, possono rimanere anche nei casi lievi.
La broncodisplasia polmonare
La broncodisplasia polmonare Bpd (neonatal chronic lung disease nCLD), comprende un numero significativo fra le patologie polmonari, che insorgono nella prima infanzia. Malgrado un miglioramento nel trattamento preventivo di questa forma patologica, come ad esempio la somministrazione di surfactante, l'induzione della maturazione polmonare tramite l'uso di corticosteroidi nel periodo pre-natale, e la messa a punto di migliori strategie di ventilazione invasiva e non invasiva, l'incidenza della Bpd non è cambiata nelle ultime decadi (Niedermaier & Hilgendorff, 2015). In uno studio europeo eseguito nel 2011, fu riportata un'incidenza pari al 10 – 20% fra tutti i neonati nati tra la 23esima e la 31esima settimana Pma. Il numero, tuttavia, varia da un'unità operativa neonatale a un'altra, raggiungendo valori di incidenza sino al 68%, in gruppi di neonati nati fra la 22esima e la 28esima settimana di gestazione. La prima forma di Bpd venne diagnosticata e studiata nel 1967 da Northway e colleghi. I reperti patologici prelevati dai bambini deceduti per questa patologia, mostrarono delle modificazioni estese di carattere infiammatorio e fibrotico a livello delle vie aeree e del parenchima polmonare (queste caratteristiche anatomo-patologiche rappresentavano quella che fu battezzata “old” Bpd) (Buczynski et al., 2013). Queste modificazioni vennero, sin da subito, associate all'utilizzo della ventilazione meccanica a lungo termine e all'esposizione ad alte concentrazioni di O2. Nel corso degli anni, tuttavia, il progresso tecnologico nel campo della ventilazione invasiva e non, associato a un più adeguato controllo sulla somministrazione di O2, e alla scoperta di terapie atte a prevenire o trattare questa patologia, diedero l'illusione d'essere riusciti a risolvere questa condizione.
Il motivo per il quale l'O2 risulta essere una delle cause principali per lo sviluppo di questa patologia, sta nel fatto che nel prematuro, lo sviluppo polmonare che solitamente si completa in utero in una gravidanza a termine, non si conclude, per cui egli nasce con dei polmoni ancora immaturi. Questa immaturità è definita sia strutturale e sia funzionale, per cui spesso questi organi sono inadeguatamente preparati a respirare ossigeno e di conseguenza mostrano la necessità di un supporto con O2 ad alti flussi, per prevenire l'ipossia tissutale e il distress respiratorio. Considerate le scarse, e talvolta assenti, difese anti – ossidanti del neonato prematuro, l'O2 provoca l'incremento del numero di Ros (Reactive oxygen species – in altre parole, radicali liberi), i quali sottopongono il soggetto a uno stress ossidativo elevato, con effetti citotossici sulle cellule del tessuto polmonare e vascolare, quindi danno il via alla cascata di reazioni che vanno a comporre il quadro fisiopatologico della Bpd.
Conseguenza sul sistema nervoso centrale
Secondo la letteratura, le conseguenze dell'iperossia a livello del sistema nervoso centrale sono di varia natura. Esse coinvolgono meccanismi fisiopatologici ed esiti diversi, e quest'ultimi possono essere riassumibili principalmente in evidenze inerenti: il rischio di emorragia nella matrice germinale (germinal matrix hemorrhage – Gmh), di emorragia intraventricolare (intraventricular hemorrhage – Ivh) e di leucomalacia periventricolare (periventricular leucomalacia – Pvl), come associazione fra prematurità (specialmente soggetti nati prima della 32esima settimana di gestazione), fragilià dei vasi sanguigni irroranti la zona della matrice germinale subependimale, e aumento della velocità del flusso sanguigno cerebrale (cerebral blood flow velocity - Cbfv) ossigeno - mediata (all'incremento della PaO2 corrisponde un aumento del Cbfv).
Di contro, altri studi riportano una diminuzione del flusso sanguigno cerebrale (cerebral blood flow) associata all'iperossia, a causa della vasocostrizione dei vasi arteriolari cerebrali e della riduzione della frequenza cardiaca, in risposta alla stimolazione/attivazione ossigeno mediata di alcune aree dell'encefalo, quali ad esempio l'ipotalamo posteriore, l'insula, l'ippocampo, il cervelletto o la regione talamica. Lo stimolo di queste regioni cerebrali si associa a risposte autonomiche, ormonali, simpaticomimetiche, talvolta rischiose per lo sviluppo, ad esempio, di cerebral palsy, ovvero di un insieme di disabilità che interessano la capacità motoria del soggetto, intesa sia come capacità di movimento, sia come capacità di coordinamento muscolare, in grado di esporlo anche al rischio di danni al sistema visivo e uditivo. In ultima analisi, i danni diretti al sistema nervoso centrale possono dipendere anche dallo stress ossidativo e dunque dalla citotossicità indotta dalla produzione massiccia di Ros, non compensata da un adeguato sistema di risposta anti – ossidante associato all'aumentata vulnerabilità dei neuroni immaturi al perossido di idrogeno (H2O2), presenti nel neonato prematuro.
I danni da stress ossidativo
La presenza dell'O2 ad accompagnare i processi metabolici della cellula, risulta in una maggiore efficienza in termini di produzione di Atp da parte di quest'ultima. La combustione mitocondriale di glucosio, aminoacidi ed acidi grassi liberi associata all'O2, arriva a produrre fino a 36 mol di Atp per 1 mol di glucosio, a fronte di 2 – 4 mol di Atp, che verrebbero prodotte attraverso una reazione metabolica anaerobia. In una condizione fisiologica, il 98% dell'O2 che entra nella cellula, viene ridotto a H2O, fatto salvo un 2% di questo che viene solo parzialmente ridotto dai mitocondri diventando O2 – producente Ros. Questa molecola viene ridotta, tramite riduzione monovalente, altre due volte, transitando per la fase di anione superossido, sino alla trasformazione in perossido di idrogeno (H2O2). Quest'ultimo subisce una terza, e ultima, riduzione monovalente, trasformandosi in radicale ossidrile altamente reattivo (highly reactive hydroxyl radical), entrando a far parte della categoria dei radicali liberi.
In condizioni ad elevato stress tissutale, quali possono essere la riperfusione post ischemica, l'infiammazione o la prolungata esposizione all'iperossia, i Ros possono indurre l'apoptosi e/o la necrosi delle cellule e del tessuto stesso. La produzione di Ros, in condizioni fisiologiche, viene contrastata e posta in equilibrio da alcuni sistemi di difesa anti – ossidanti presenti nella struttura cellulare e nel tessuto interstiziale. Queste difese, si suddividono in due categorie: enzimatiche (ad esempio, l'enzima superossido dismutasi, o gli enzimi catalasi e glutatione perossidasi) e non enzimatiche (ad esempio, le vitamine C e E o il β – carotene). Un adeguato equilibrio fra elementi pro – ossidanti ed anti – ossidanti è essenziale per il buon svolgimento dei processi biologici.
Infatti, l'iperossia è una fra le cause di squilibrio in questo rapporto e questo diventa estremamente importante per quanto concerne i neonati prematuri o estremamente prematuri, nei quali, da una parte si rende necessaria l'O2 terapia, per prevenire o trattare una condizione di ipossia tissutale e le sue conseguenze annesse (un esempio di conseguenza estrema dell'ipossia è la morte del neonato), dall'altra si rende altrettanto necessario evitare una condizione iperossica, considerate anche le immature difese anti – ossidanti di cui un soggetto simile dispone. Lo stress ossidativo è indissolubilmente legato a un elevato rischio di sviluppare conseguenze importanti a breve e a lungo termine, a carico di diversi organi e/o tessuti con diversa gravità, come ad esempio a livello dell'encefalo e del sistema nervoso centrale (Gmh, Ivh), dei polmoni (Bpd), dell'unità cellulare (arresto temporaneo o permanente della crescita cellulare e morte, apoptosi o necrosi, alterazioni a carico del Dna, con potenziale effetto cancerogeno ancora oggi oggetto di studio e ricerca).
Le conseguenze ossigeno-mediate coinvolgono diversi tessuti, organi e apparati, in modalità e gravità differenti. Un'eccessiva quantità di O2 e una sua protratta e non necessaria esposizione, suscitano risposte patologiche nel neonato, in grado di comportare esiti più o meno invalidanti, quali cecità, insufficienza respiratoria, emorragia cerebrale, deficit di movimento e di coordinamento muscolare, risposte autonomiche e ormonali inadeguate, deficit uditivo, alterazione del Dna e dei processi cellulari.
Articolo redatto in collaborazione con Dr. Michele Castellin
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?