L’equilibrio acido-base può essere definito l’equilibrio degli equilibri perché alla fine di tutte le attività metaboliche è quello che mantiene nella norma le funzioni più vitali e più indispensabili alla sopravvivenza. L’articolo si propone di esporre come con poche e semplici regole, tutti possiamo essere in grado di leggere un risultato di Emogasanalisi (EGA), e non comportandoci come “i cattolici verso la Bibbia: ne hanno un grande rispetto e questo rispetto lo dimostrano standone il più lontano possibile”.
Equilibrio Acido-Base (EAB)
La procedura di prelievo arterioso, che può effettuare un medico o un Infermiere con abilità aquisite e con provata esperienza, prevede un accesso in arteria e con paziente nella maggior parte delle volte cosciente, dunque, è necessario tenere nella dovuta considerazione le conseguenze e gli inconvenienti relativi a queste due condizioni.
| Valori normali EGA |
||||
|
pO2 80-85 mmHg |
pH 7,35–7,45 |
pCO2 35-45 mmHg |
pO2/FiO2 >400 |
HCO3- 24-26 mEq/l |
|
SaO2 Saturazione di ossigeno > 95% |
PaO2: > 80-100 mmHg (i valori fisiologici diminuiscono con l’età; sottrarre 1 mm/Hg da 80 mm/Hg per ogni anno di età sopra i 60 anni e fino ai 90 (Fischbach e Dunning, 2006) | tHb :11-17 g/dL | Na+ :135-145 mEq/L | Na+ :135-145 mEq/L |
|
Cl- :95-105 mEq/L |
Cl- :95-105 mEq/L | Cl- :95-105 mEq/L | K+ :3.50-4.50 mEq/L | K+ :3.50-4.50 mEq/L |
|
Ca2+ :4.49-5.29 mEq/L |
Eccessi o deficit delle basi BE+/BE- :+/-2 mEq/L | Ca2+ :4.49-5.29 mEq/L |
Lattato :0.3-1.3 mEq/L | Glucosio :60-110 mg/dL |
Interpretando i parametri dell'emogasanalisi è possibile ottenere importanti informazioni cliniche che guidino o confermino la diagnosi clinica, come ad esempio, nel caso dell’insufficienza respiratoria o dei disordini dell’equilibrio elettrolitico; inoltre, attraverso la valutazione dei risultati ottenuti è possibile monitorare l’efficacia dei trattamenti terapeutici. Senza entrare in dettagli clinici e senza pretendere di poter sviscerare i risvolti interpretativi di tutti i parametri ottenibili attraverso l’EAB, con i pochi esempi che seguono si vuole dimostrare che rispettando una corretta metolodogia e servendosi anche solo di pochi parametri fra quelli disponibili per l’EAB, è possibile inquadrare i diversi disordini dell’equilibrio acido-base e, nel caso di insufficienza respiratoria, stabilire immediatamente la diagnosi.
Si riconoscono quattro forme di disordini dell’EAB (definiti semplici), in circa la metà dei pazienti più di una di queste forme possono coesistere, più si dà origine a disturbi misti dell’EAB.
Disordini semplici dell’Equilibrio Acido-base
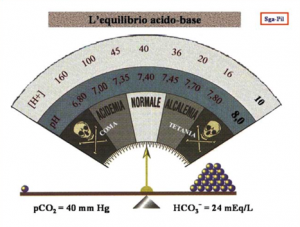
L'Equilibrio Acido-Base.
- acidosi metabolica: legata ad un eccesso, relativo o assoluto di acidi fissi nel sangue (eccesso assoluto o relativo di ioni H+) rispetto alle basi tampone.
“Assoluto o relativo” si riferisce al fatto che l’acidosi metabolica deriva da un’alterazione dell’equilibrio che gli H+ (acidi) e le basi (HCO3-), tale alterazione può dipendere da un aumento degli H+ (“eccesso assoluto”) oppure può essere dovuto ad una diminuzione delle basi (HCO3-), pertanto gli acidi (H+) si ritrovano in eccesso rispetto alle basi (“eccesso relativo). Un esempio di acidosi metabolica da eccesso assoluto di H+ si verifica nella chetoacidosi diabetica e alcolica, in alcune intossicazioni, nelle situazioni che determinano acidosi lattica come lo shock, l’etilismo, alterazioni del metabolismo glicidico. Opportuno il ricorso alla somministrazione di basi tampone come il bicarbonato di sodio.
- acidosi respiratoria: aumentata produzione di PCO2>44; PH <7.38. Può manifestarsi in corso di febbre, sforzo, dieta abnormemente ricca di glucidi;
- alcalosi metabolica: dovuta ad eccessiva perdita di idrogenioni e di altri elettroliti come avviene nel vomito o nelle occlusioni intestinali o per cause renali come nell’iperaldosteronismo primario e secondario o per l’utilizzo di alcuni diuretici. Altre volte è legata all’aumento delle basi tampone come può accadere per abuso di assunzione di bicarbonato o in antibioticoterapie ad alte dosi con penicillina (perdita di K), o nel corso di alcuni stati caratterizzati da ipovolemie gravi.
- alcalosi respiratoria: dovuta ad un eccesso relativo di bicarbonati che deriva da iperventilazione con conseguente bassa pCO2. Le cause più comuni di iperventilazione sono la sindrome da iperventilazione, la superventilazione nei pazienti in ventilazione assistita , disturbi primitivi del SNC, intossicazione da salicilati, il coma epatico (sonnolenza,cefalea, psicosi, irritabilita’ neuromuscolare, alterazione del ritmo, coma);
L’equilibrio deve essere inteso in questo modo: la doccia ha due manopole, una per l’acqua calda e una per l’acqua fredda. Manovrando, ora l’una ora l’altra, è possibile ottenere la giusta temperatura. Lucianao De Crescenzo
Infatti, in tutti i disordini dell’EAB, esistono delle semplici regole numeriche, che ci aiutano a riconoscere le varie forme, e a distinguere i disordini semplici da quelli misti.
Queste regole sono:
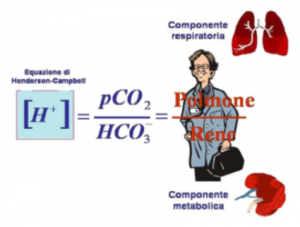
L'equazione di Henderson-Campbell.
- Il pH deve corrispondere all’andamento di HCO3- e CO2;
- Se uno degli elementi della coppia tampone si modifica (aumenta o diminuisce) l’altro elemento deve modificarsi nello stesso senso (altrimenti siamo di fronte ad un disturbo misto);
- Se uno degli elementi della coppia tampone si modifica, l’altro deve modificarsi in una misura precisa, secondo una regola definita “dei compensi attesi”.
Tali “compensi attesi” permettono di capire se il disturbo è SEMPLICE (quando il compenso atteso viene soddisfatto) o se è MISTO (quando il compenso non è soddisfatto.
Riconoscere un disturbo misto significa comprendere un quadro clinico ed eseguire un’adeguata terapia.
Valutazione dell’Equilibrio Acido-Base (EAB)
Per la valutazione dell’EAB esistono una serie di nomogrammi attraverso i quali è possibile, partendo dai valori di HCO3- e pCO2 stabilire se il soggetto si trova in condizioni normo metaboliche, oppure in acidosi o alcalosi, metabolica o respiratoria.
Acidosi respiratoria
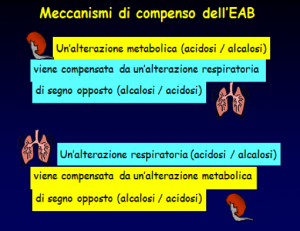
Equilibrio Acido Base: i meccanismi di compenso messi in piedi dal corpo umano.
L’acidosi respiratoria è dovuta ad alterazioni nella ventilazione polmonare; di conseguenza vi è una ridotta eliminazione di CO2 che aumenta nel sangue. La reazione del sistema tampone del HCO3- si sposta verso la produzione di HCO3-, che a sua volta aumenta nel sangue (anche se di meno rispetto alla CO2). Quindi, il rapporto HCO3- /CO2, e di conseguenza il valore di pH arterioso diminuiscono. Anche nell’acidosi respiratoria esiste la regola dei compensi attesi: in particolare, per ogni 10 mmHg di aumento della pCO2, si verifica un aumento di 1 mEq/L della concentrazione di HCO3-. Quindi, se in condizioni normali le concentrazioni di HCO3- e CO2 sono rispettivamente:
40 mmHg CO2; 24 mEq/L di HCO3-;
Ci aspettiamo che un quadro di acidosi respiratoria fornisca i seguenti risultati:
pH < 7.4 ….. 50mmHg CO2; …. 25 mEq/L di HCO3-.

Il compenso spontaneo attuato del corpo umano.
Come si vede, sono rispettate le tre condizioni: entrambi gli elementi della coppia sono aumentati; il pH indica acidosi; la regola dei compensi è rispettata. Infatti, la pCO2 è aumentata di 10 mmHg e HCO3- è aumentato di 1 mEq/L. Quindi, si tratta di un quadro compatibile con acidosi respiratoria pura, e non con un disturbo misto. Per il resto, il laboratorio non offre un grosso contributo alla diagnosi di acidosi respiratoria; le cause (neurologiche, meccaniche, etc.) che determinano l’acidosi vengono definite su base clinica.
Caso clinico 1
Paziente maschio 70 Kg sviluppa ostruzione delle vie aeree acuta durante anestesia.
EGA:
- PH = 7.32;
- PaCO2 = 70 mmHg;
- HCO3- = 27 mmol/l.
- Acidosi respiratoria con buon compenso metabolico.
Alcalosi respiratoria.
L’alcalosi respiratoria è dovuta all’aumentata eliminazione di CO2 attraverso la respirazione che causa uno spostamento della reazione del sistema tampone del HCO3- (che a sua volta diminuisce, anche se in misura minore rispetto alla CO2). Quindi, il rapporto HCO3- /CO2, ed il valore di pH arterioso risultano aumentati.
Anche per riconoscere l’alcalosi respiratoria vale la regola dei compensi attesi: in particolare, per ogni 10 mmHg di riduzione della pCO2, è attesa una riduzione di 2 mEq/L della concentrazione di HCO3-.Quindi, se in condizioni normali le concentrazioni di HCO3- e CO2 sono rispettivamente:
- 24 mEq/L diHCO3-; 40 mmHg CO2;
ci aspettiamo che un quadro di alcalosi respiratoria fornisca i seguenti risultati:
- pH>7.4 ; 20 mmHg CO2 ; 20 mEq/L di HCO3-.
Come si vede, sono rispettate le tre condizioni: entrambi gli elementi della coppia sono aumentati; il pH indica alcalosi; la regola dei compensi è rispettata. Infatti, la pCO2 è ridotta di 20 mmHg e quindi la concentrazione di HCO3- è ridotta di 4 mEq/L. Quindi, si tratta di un quadro compatibile con alcalosi respiratoria pura, e non con un disturbo misto.
Caso clinico 2
Donna in PS per iperpiressia,disuria,disidratazione,ipotensione,vomito,vescica neurologica.
EGA:
- PH=7,55;
- PaCO2 = 23;
- HCO3=20;
- PaO2=98;
- NA+=140;
- K+=3.0;
- CL=98.
- Alcalosi respiratoria in corso di Sepsi.
Acidosi metabolica

I disordini dell'EAB.
Senza entrare in dettaglio su tutte le cause di acidosi metabolica , possiamo dire che l’acidosi metabolica è dovuta a:
- eccessiva produzione di acidi (acidosi lattica, chetoacidosi);
- ridotta eliminazione di acidi da parte del rene, in genere a causa di una ridotta filtrazione glomerulare;
- eccessiva perdita di bicarbonato (attraverso le feci, a causa di diarrea, o con le urine a causa dell’incapacità dei tubuli di attuare i meccanismi di recupero del bicarbonato).
L’eccesso di H+ fa spostare la reazione del tampone bicarbonato (quindi il bicarbonato diminuisce molto), si produce CO2 in eccesso, ma la rapida attivazione del compenso respiratorio (iperventilazione) fa rapidamente ridurre i livelli di CO2 (anche se la riduzione è minore rispetto alla riduzione del bicarbonato).
La regola dei compensi attesi per l’acidosi metabolica prevede che, per ogni mEq di bicarbonato che diminuisce, vi sia una diminuzione di 1.2 mmHg della pCO2. Quindi, se in condizioni normali le concentrazioni di bicarbonato e CO2 sono rispettivamente:
- 24 mEq/L di HCO3- ; 40 mmHg CO2
ci aspettiamo che un quadro di acidosi metabolica fornisca i seguenti risultati:
- pH < 7.4; 18 mEq/L di HCO3- ; 32.8 mmHg CO2.
Come si vede, sono rispettate le tre condizioni: entrambi gli elementi della coppia sono diminuiti; il pH indica acidosi; la regola dei compensi è rispettata. Infatti, il bicarbonato è diminuito di 6 mEq/L e quindi la CO2 è ridotta di 7.2 mmHg (1.2 x 6).
Quindi, si tratta di un quadro compatibile con acidosi metabolica pura, e non con un disturbo misto.
Una volta confermato che si tratta di acidosi metabolica, il laboratorio può contribuire a definire la causa. In particolare, può essere utile stabilire se si tratta di un’acidosi dovuta ad eccessiva produzione di acidi, oppure alla ridotta eliminazione renale di acidi, oppure infine se si tratta di un’acidosi da perdita di bicarbonato. Il laboratorio può contribuire anche ad identificare le acidosi dovute a ridotta eliminazione renale (legate in genere a ridotta filtrazione glomerulare). Infatti, in queste forme potremo documentare un aumento sierico di creatinina o un’alterazione della clearance della creatinina non presenti nelle altre forme di acidosi renale. Infine, nelle acidosi legate ad aumentata produzioni di acidi, il laboratorio può contribuire ad identificare la causa: per esempio, è possibile documentare un aumento plasmatico del lattato e quindi orientarsi verso un’acidosi lattica; ancora, è possibile dosare i chetoni e quindi documentare una chetoacidosi e attraverso la valutazione del glucosio ed altri parametri del metabolismo glicidico, stabilire che si tratta di una chetoacidosi diabetica, e così via.
Caso clinico 3
Uomo di 58AA, in stato stuporoso dopo aver ingerito accidentalmente liquido antigelo per il motore, dispnoico, PA 110/70 mmHg, FC 110 b/m.
EGA:
- PH=6,95;
- PaCO2=12;
- HCO3=3;
- NA+=140;
- K+=5;
- CL=103.
- Acidosi metabolica.
Alcalosi metabolica.
L’alcalosi metabolica è dovuta a perdita di acidi (attraverso le feci, vomito, etc.), che causa uno spostamento della reazione del sistema tampone del HCO3- (che aumenta); l’apparato respiratorio reagisce riducendo la ventilazione polmonare e quindi anche la pCO2 aumenta (di meno rispetto al HCO3-). Quindi, il rapporto HCO3-/CO2, e di conseguenza il valore di pH arterioso risultano aumentati. Anche nell’alcalosi metabolica esiste la regola dei compensi attesi: in particolare, per ogni 10 mEq/L di aumento della concentrazione del HCO3-, si verifica un aumento di 7 mmHg della pCO2.
Quindi, se in condizioni normali le concentrazioni di HCO3- e CO2 sono rispettivamente:
- 24 mEq/L di HCO3-; 40 mmHg CO2;
ci aspettiamo che un quadro di alcalosi respiratoria fornisca i seguenti risultati:
- pH>7.4 34 mEq/L di HCO3-; 47 mmHg CO2.
Come si vede, sono rispettate le tre condizioni: entrambi gli elementi della coppia sono aumentati; il pH indica alcalosi; la regola dei compensi è rispettata. Infatti, la concentrazione di HCO3- è aumentata di 10 mEq/L e la pCO2 è aumentata di 7 mmHg. Quindi, si tratta di un quadro compatibile con l’alcalosi metabolica pura, e non con un disturbo misto.
Caso clinico 4
Uomo di 78 AA in stato confusionale e grave disidratazione, scompenso cardiaco cronico, PA 90/70 mmHg, GCS 13.
EGA:
- PH=7,52;
- PaCO2=48;
- HCO3=38;
- PO2=75;
- NA+=140;
- K+=2,2.
Alcalosi metabolica per uso eccessivo di diuretici.
Caso clinico 5
Donna di 68 anni arriva in Pronto Soccorso perché affetta da circa tre giorni da diarrea, con molte scariche al giorno. La paziente ha seguito, recentemente, terapia antibiotica per polmonite destra ormai risolta.
EGA:
- PH 7.29;
- PaCO² 28mmHg;
- HCO³¯ 14 mEq/L;
- Na 141 mEq/L;
- K 3.O mEq/L ;
- Cl 115mEq/L.
Risposta: Acidosi metabolica semplice con ipercloremia.
Caso clinico 6
Un signore di 73 aa., affetto da broncopneumopatia cronica ostruttiva e insufficienza cardiaca a prevalenza destra arriva in pronto soccorso per dispnea ed edemi agli arti inferiori. Terapia a domicilio: teofillina, steroidi per via inalatoria e diuretici.
EGA:
- PH 7,40;
- PaC02 67 mmHg;
- HCO³¯ 40 mEq/l;
- PaO2 48 mmHg.
- Na 140; K 3.5;
- Cl 90 mEq/l.
- Acidosi respiratoria e concomitante alcalosi metabolica.
Caso clinico 7
Un signore di 81 aa., con precedenti di cardiopatia ischemica, arriva in Pronto Soccorso,per edema polmonare acuto. All’esame clinico chiari segni di fatica respiratoria. PA 180/110 mmHg; Fc 110 b/m; Fr 38 a/m.
EGA:
- PH 7.15;
- PaCO²mmHg 50;
- HCO³¯ 17mEq/L;
- PaO2 28 mmHg;
- Elettroliti: Na 140 mEq/L; K 5.0 mEq/L; Cl 103 mEq/L.
- Acidosi respiratoria con acidosi metabolica
In conclusione possiamo dire che l’attenta valutazione clinica del paziente e l’analisi dei dati secondo il percorso descritto permettono con una certa facilità di evidenziare i disordini dell’equilibrio acido-base. In definitiva, la valutazione dell’equilibiro acido-base è una competenza trasversale a tutte le specialità mediche, dunque, non deve essere trascurato o demandato agli “esperti”, c’è sempre spazio e necessità per approfondire ma è importante tenere presente che per una valutazione dell’EAB gli elementi fondamentali da considerare sono tre: il ph, la pCO2 e i bicarbonati; la valutazione di queste tre variabili secondo le regole descritte e la concomitante valutazione del quadro clinico del paziente, guideranno l’iter diagnostico e terapeutico.
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?