Sono stati recentemente pubblicati sulla prestigiosa rivista Lancet i risultati rispetto alla Fase 3 di sperimentazione del vaccino Sputnik V prodotto in Russia. I risultati sono eccellenti e, una volta che le agenzie internazionali del farmaco lo approveranno per la somministrazione, una nuova arma contro il Covid si affiancherà a quelle già esistenti.
Come funziona il vaccino Sputnik V
La sperimentazione del vaccino russo Sputnik V ha dato risultati eccellenti
Per verificare la sicurezza e l’efficacia del vaccino in esame è stato condotto uno studio di fase 3 randomizzato, in doppio cieco, controllato con placebo in 25 ospedali e policlinici a Mosca.
Sono stati inclusi partecipanti di almeno 18 anni, con test PCR e IgG/IgM per SARS-CoV-2 negativi, nessuna malattia infettiva nei 14 giorni precedenti l’arruolamento e nessun’altra vaccinazione nei 30 giorni precedenti l’arruolamento. I partecipanti sono stati assegnati in modo casuale con rapporto 3:1 a ricevere vaccino o placebo, con stratificazione per gruppo di età.
Il vaccino a vettore adenovirale
La sicurezza dei vaccini a vettore adenovirale è stata ampiamente studiata e nella pratica clinica vengono già utilizzati farmaci terapeutici a base di vettore adenovirale. È noto come gli antigeni adenovirali veicolati inducono l’immunità sia cellulare che umorale dopo una singola immunizzazione, consentendo il loro utilizzo come strumento di profilassi di emergenza in una pandemia.
Inoltre, la somministrazione di due immunizzazioni fornisce una risposta immunitaria durevole e duratura. Queste caratteristiche rendono i vaccini a base di adenovirus ricombinante con deficit di replicazione (rAd) candidati idonei per i profili dei prodotti target dell’OMS per la protezione a lungo termine delle persone ad alto rischio di Covid-19 in contesti epidemici perché stimolano una rapida insorgenza dell’immunità protettiva.
Sebbene i vettori adenovirali possano indurre risposte immunitarie contro i componenti del vettore e attenuare le risposte indotte dall’antigene, la vaccinazione eterologa prime-boost con due diversi vettori consente di minimizzare questo effetto. Pertanto, l’approccio più efficace per generare una risposta immunitaria potente e duratura che non dipende dalla presenza di una risposta immunitaria preesistente al vettore è l’approccio di vaccinazione con prime-boost eterologo e proprio questo approccio è stato quello adottato durante lo sviluppo del vaccino Sputnik V.
Gam-COVID-Vac è un vaccino vettore combinato, basato su rAd di tipo 26 (rAd26) e rAd di tipo 5 (rAd5), entrambi portatori del gene della glicoproteina spike a tutta lunghezza del virus SARS-CoV-2 (rAd26-S e rAd5 -S). rAd26-S e rAd5-S vengono somministrati per via intramuscolare separatamente con un intervallo di 21 giorni l’uno dall’altro.
Caratteristiche del campione dello studio
Tra il 7 settembre e il 24 novembre 2020, 21977 adulti sono risultati ammissibili e assegnati in modo casuale a ricevere placebo (n = 5476) o vaccino (n = 16501). Il primo blocco del database è stato il 18 novembre 2020, quando sono stati segnalati 20 casi di Covid-19. L’analisi provvisoria della sicurezza (analisi di eventi avversi rari) è stata eseguita con i dati giunti fino al primo blocco del database.
Poiché si è verificato un aumento dell’incidenza di Covid-19 a Mosca nel mese di novembre, il secondo blocco del database è stato effettuato il 24 novembre 2020, quando erano stati segnalati 78 casi di Covid-19.
I dati per l’analisi ad interim di efficacia e per l’analisi degli eventi avversi gravi vengono presentati fino al secondo blocco del database. 74 partecipanti del gruppo vaccino e 41 del gruppo placebo sono stati esclusi dalle analisi e l’analisi preliminare ha dunque incluso 16427 partecipanti per il gruppo vaccino e 5435 per il gruppo placebo. 14.964 nel gruppo vaccino e 4902 nel gruppo placebo avevano ricevuto due dosi al momento del blocco del database (24 novembre 2020) e sono state incluse nell’analisi di esito primario.
Il tempo mediano dei partecipanti che hanno ricevuto la prima dose alla data di blocco del database è stato di 48 giorni (IQR 39-58). Tra i partecipanti che hanno ricevuto due dosi, l’età media era di 45,3 anni (SD 12,0) nel gruppo vaccino e di 45,3 anni (SD 11,9) nel gruppo placebo; la distribuzione per sesso (p = 0.619), l’incidenza di malattie concomitanti (p = 0.420) e il rischio di infezione (p = 0.851) erano simili tra i due gruppi.
Outcome dello studio su Sputnik V
Sicurezza
Sono stati valutati l’incidenza e la gravità degli eventi avversi e gli eventi avversi gravi sono stati diagnosticati sulla base dell’evento che ha richiesto il ricovero ospedaliero.
Efficacia
Outcome primario
L’outcome primario era la percentuale di partecipanti con Covid-19 confermato dalla PCR a partire dal giorno 21 dopo aver ricevuto la prima dose.
Outcome secondari
Gli esiti secondari erano:
- Gravità di Covid-19
- Cambiamenti nei livelli di anticorpi contro la glicoproteina S del virus Sars-CoV-2
- Proporzione di partecipanti con anticorpi contro la proteina N SARS-CoV-2
- Cambiamenti nei titoli degli anticorpi neutralizzanti SARS-CoV-2 (aumento dei titoli)
- Cambiamenti nel livello di immunità cellulare antigene-specifica (aumento della risposta immunitaria cellulo-mediata all’antigene)
Risultati
Sicurezza
Le analisi sulla sicurezza generale e sugli eventi avversi rari hanno incluso 12296 partecipanti che hanno ricevuto entrambe le dosi fino al blocco del database il 18 novembre 2020. Gli eventi avversi più comuni sono stati malattia simil-influenzale, reazioni nel sito di iniezione, cefalea e astenia.
La maggior parte degli eventi avversi segnalati (7485 [94,0%] su 7966) erano di grado 1; 451 erano di grado 2 (5.66%) e 30 erano di grado 3 (0.38%). Nello studio sono stati riportati 122 eventi avversi rari (91 nel gruppo vaccino e 31 nel gruppo placebo).
L’analisi degli eventi avversi gravi ha incluso 21862 partecipanti che hanno ricevuto almeno una dose (di cui 19866 hanno ricevuto due dosi) fino al blocco del database il 24 novembre 2020. Sono stati registrati 70 episodi di eventi avversi gravi, considerati non correlati a Covid-19 in 68 partecipanti: in 45 (0,3%) di 16427 partecipanti dal gruppo vaccino e 23 (0,4%) di 5435 partecipanti dal gruppo placebo.
Nessuno degli eventi avversi gravi è stato considerato associato alla vaccinazione, come confermato dal comitato indipendente di monitoraggio dei dati. Poiché c’erano pochi eventi avversi gravi, è stato possibile elaborare e verificare i dati degli eventi avversi gravi fino al secondo blocco del database; tuttavia, i dati completi sugli eventi avversi che non sono stati ancora elaborati verranno forniti in una pubblicazione successiva per evitare discrepanze con il rapporto finale una volta completata l’elaborazione completa dei dati.
Durante lo studio sono stati registrati 4 decessi: 3 (<0,1%) di 16427 partecipanti al gruppo vaccino e 1 (<0,1%) di 5435 partecipanti al gruppo placebo. Non sono stati segnalati decessi correlati al vaccino. Nel gruppo vaccino, un decesso è stato associato a frattura di una vertebra toracica e gli altri due sono stati associati a Covid-19 (un paziente con un background cardiovascolare grave che ha sviluppato sintomi il giorno 4 dopo la prima dose e un paziente con un background comorbilità endocrinologica che ha sviluppato sintomi il giorno 5 dopo la prima dose).
In base al periodo di incubazione della malattia, entrambi i partecipanti sono stati ritenuti già infetti prima di essere inclusi nello studio, nonostante il test PCR negativo. Nel gruppo placebo, la morte è stata associata a ictus emorragico. 1369 partecipanti di età superiore a 60 anni sono stati inclusi nell’analisi di sicurezza.
Gli eventi avversi più comuni sono stati la malattia simil-influenzale in 156 (15,2%) e la reazione locale in 56 (5,4%) di 1029 partecipanti al gruppo vaccino e 30 (8,8%) e 4 (1,2 %) di 340 partecipanti al gruppo placebo. Si sono verificati tre episodi di eventi avversi di grado 3 o peggiore, considerati non associati alla vaccinazione: un’esacerbazione di urolitiasi e sinusite acuta nel gruppo vaccino e una malattia simil-influenzale nel gruppo placebo. Tutti questi eventi avversi sono stati risolti.
Nei partecipanti di età superiore a 60 anni, ci sono stati tre eventi avversi gravi riportati nel gruppo vaccino: colica renale e trombosi venosa profonda (entrambe associate a comorbilità preesistenti) e ascesso delle estremità (a causa di lesioni fisiche e successiva infezione della superficie della ferita dei tessuti molli del dito). Non è stata trovata alcuna associazione tra eventi avversi gravi e somministrazione del vaccino.
Efficacia
A partire da 21 giorni dopo la prima dose di vaccino (il giorno della dose 2), 16 casi di Covid-19 sono stati confermati nel gruppo vaccino (0,1%) e 62 casi sono stati confermati nel gruppo placebo (1,3%); l’efficacia del vaccino è dunque del 91,6% (IC 95%; 85,6 – 95,2). L’efficacia del vaccino osservata è stata superiore all’87% in tutti i sottogruppi di età e sesso.
In particolare, l’efficacia del vaccino è stata del 91,8% (67,1 –98,3) nei partecipanti di età superiore ai 60 anni. Ci sono stati 0 casi (gruppo vaccino) e 20 casi (gruppo placebo) di Covid-19 moderato o grave confermati almeno 21 giorni dopo la dose 1; per questo motivo, l’efficacia del vaccino contro Covid-19 moderato o grave è del 100% (94,4-100,0). Da 15 a 21 giorni dopo la prima dose, l’efficacia è stata del 73,6% (p = 0,048), poi dal giorno 21 l’efficacia è stata del 100% (p < 0,0001).
L’efficacia stimata del vaccino contro il Covid-19 confermato che si verificava in qualsiasi momento dopo la dose 1 era del 73,1% (IC 95%; 63,7 – 80,1). In particolare, nel gruppo vaccino la maggior parte dei casi di Covid-19 si è verificata prima della dose 2.
I tassi di insorgenza della malattia sono stati simili per i gruppi vaccino e placebo fino a circa 16-18 giorni dopo la dose 1, dopodiché l’inizio precoce della protezione ha portato il numero di casi nel gruppo vaccinato ad aumentare molto più lentamente rispetto al gruppo placebo.
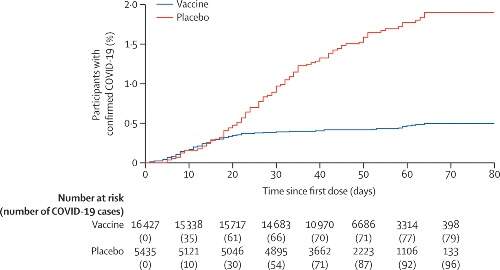
L’analisi ad interim di immunogenicità includeva campioni trasferiti dal laboratorio centrale che sono stati raccolti prima del 30 novembre 2020 e ha dimostrato che il vaccino induce una risposta immunitaria nei partecipanti.
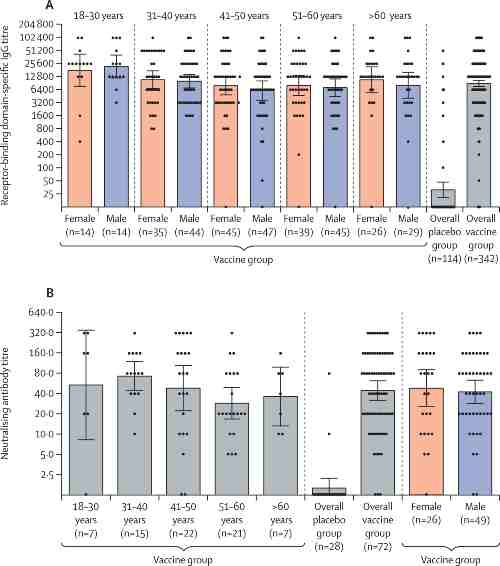
Prima della prima vaccinazione, non sono stati rilevati anticorpi specifici per RBD o anticorpi neutralizzanti virus nel siero del sangue dei partecipanti. Nell’analisi della risposta immunitaria umorale sono stati analizzati campioni di siero di 456 partecipanti (342 dal gruppo vaccino e 114 dal gruppo placebo) per la presenza di anticorpi specifici per il dominio di legame del recettore della glicoproteina spike del virus Sars-CoV-2 42 giorni dall’inizio della vaccinazione.
Nel gruppo vaccino, le IgG specifiche per RBD sono state rilevate in 336 (98%) di 342 campioni, con una media geometrica del titolo (GMT) di 8996 (IC 95%; 7610 – 10635) e un tasso di sieroconversione del 98,25%. Nel gruppo placebo, le IgG specifiche per RBD sono state rilevate in 17 (15%) di 114 campioni, con un GMT di 30.55 (20.18 – 46.26) e un tasso di sieroconversione del 14.91% (p < 0.0001 rispetto al gruppo vaccino).
Confrontando il livello di anticorpi specifici per RBD tra le fasce di età i ricercatori hanno notato che il gruppo di età compresa tra 18 e 30 anni (maschi e femmine combinati) aveva un GMT significativamente più alto rispetto agli altri gruppi di età (p = 0.0065). Non c’erano differenze tra gli altri gruppi di età (p = 0,343). I livelli di anticorpi non differivano significativamente tra uomini (n = 179) e donne (n = 159; p = 0,258).
Per valutare l’induzione di una risposta immunitaria umorale sono stati analizzati i campioni di siero di 100 partecipanti per la presenza di anticorpi neutralizzanti il giorno 42 dopo la prima vaccinazione; il GMT degli anticorpi neutralizzanti era 44,5 (IC 95%; 31,8 – 62,2) e il livello di sieroconversione era 95,83% nel gruppo vaccino. La GMT nel gruppo placebo era 1.6 (1.12 – 2.19) e il tasso di sieroconversione era 7.14%, che era significativamente inferiore a quello nel gruppo vaccino (p < 0.0001). I livelli di anticorpi neutralizzanti erano simili tra gli strati di età (p = 0,222) e tra uomini e donne (p = 0,639).
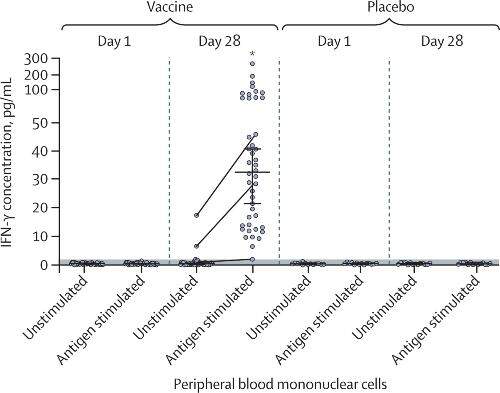
La risposta immunitaria cellulare nei partecipanti è stata caratterizzata dalla secrezione di IFN-γ di cellule mononucleate del sangue dopo re-stimolazione della glicoproteina spike in coltura del virus SARS-CoV-2. Per valutare la risposta immunitaria cellulare sono stati analizzati campioni di siero di 58 partecipanti (44 del gruppo vaccino e 14 del gruppo placebo).
Al giorno 28 dopo la prima vaccinazione tutti i partecipanti del gruppo vaccino avevano livelli significativamente più alti di secrezione di IFN-γ alla re-stimolazione dell’antigene (mediana 32,77pg/mL [IQR 13.94 – 50.76]) rispetto al giorno di somministrazione della prima dose.
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?